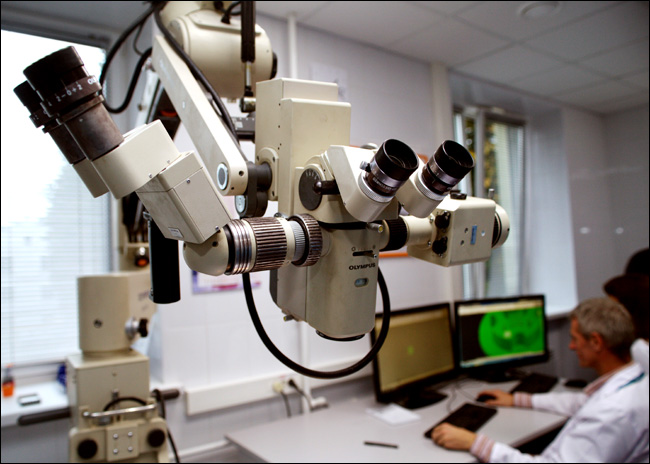
Это из новой лаборатории 3D-печати органов. Спереди внушительный микроскоп, дальше видно двух медицинских инженеров за AutoCAD - делают макет площадки для формирования тканевых сфероидов.
Тут недавно открылась лаборатория 3D-биопринтинга органов (проект Инвитро). Вокруг неё творится какая-то лютая феерия непонимания того, что именно делается. В общем, хоть я и не микробиолог, но мне стало интересно. Я пробился до разработчика - В.А. Миронова. Именно он изобрёл технологию печати органов и запатентовал это в США, участвовал в разработке уже трех модификаций биопринтеров, и именно он "главный по науке" в новой лаборатории в Москве:

В.А. Миронов (M.D., Ph.D., профессор с 20-летним опытом в микробиологии, в частности, на границе с IT) - в процессе полуторачасового объяснения мне сути технологии изрисовал кучу бумаги.
В двух словах о печати он рассказать не смог, потому что сначала надо понять некоторую историю вопроса. Например, почему пришлось отбросить светлую идею растить эмбриона без головы в суррогатной матери, а затем вынимать из него почку и помещать её в биораставор для ускоренного созревания.
А пока главное. Не торопитесь пить всё что горит: до новой печени ещё очень далеко. Поехали.
Эволюция методов
Итак, сначала была генная терапия: пациенту вводились соответствующие комплексы. Выделялись определённые клетки, в них вводились нужные гены, затем клетки размещались в организме человека. Не хватало инсулина - вот ген, который продуцирует его создание. Берём клеточный комплекс, модифицируем, вкалываем пациенту. Идея - отличная, правда с одним коренным недостатком: пациент вылечивается сразу, и покупать после операции ничего не надо. То есть догадайтесь, кому это было поперёк горла. Дело шло сложно, а потом один из пациентов умер - и началась характерная для США волна судебных исков и запретов, в результате чего исследования пришлось свернуть. В итоге - метод есть, но толком не оттестирован.
Следующим трендом стала клеточная терапия - использование эмбриональных стволовых клеток. Метод отличный: берутся "универсальные" клетки, которые могут быть развиты до любых необходимых пациенту. Проблема в том, что чтобы их где-то получить, нужен эмбрион. Эмбрион в процессе получения клеток, очевидно, расходуется. А это уже морально-этическая проблема, которая вызвала запрет использования таких клеток.
Дальше - тканевая инженерия - это когда вы берёте основу, кладёте на неё клетки, засовываете всё это в биореактор, на выходе получаете результат (орган), который нужен пациенту. Как протез, только живой. Вот здесь важный момент: основное отличие от протеза в том, что протез изначально из неорганики, и вряд ли когда-нибудь встроится в организм "как родной". Деревянную ногу не почешешь.
Методы тканевой инженерии бывают каркасные - когда используется выщелоченный (обесклеченный) трупный орган, который затем "заселяется" клетками пациента. Другие научные группы пробовали работать со свиными белковыми каркасами органов (доноры-люди не нужны, зато во весь рост встаёт иммуносовместимость). Каркасы бывают искусственные - из разных материалов, некоторые научные группы экспериментировали даже с сахаром.
Сам Миронов практикует бескаркасную технологию (с использованием гидрогеля в качестве основы). В его методе основа-полимер быстро деградирует и в итоге остаётся только клеточный материал. Проще говоря, сначала вставляется каркас из неограники с размещёнными клетками, а затем каркас "растворяется", и его функции берут на себя сами клетки уже подросшего органа. Для каркасов используется тот же материал, что для хирургических швов: он легко и просто деградирует в организме человека.
Тут главный вопрос - почему нужна именно 3D-печать. Чтобы это понять, давайте закопаемся ещё чуть глубже в имеющиеся методы тканевой инженерии.
Приближаемся к цели
Вообще, идея вставлять в человека заранее выращенный органический орган - отличная. Посмотрим на три варианта развития технологии:
- Вы берёте каркас из неорганики, засеиваете его клетками - и получаете готовый орган. Метод грубый, но работающий. Именно про него речь в большинстве тех случаев, когда говорят "мы напечатали орган". Проблема в том, что где-то нужно взять "стройматериал" - сами клетки. А если они есть, то глупо использовать какой-то внешний каркас, когда есть возможность просто собрать орган из них. Но самая болезненная проблема - неполная эндотелизация. Например, для бронхов, сделанных так, уровень - около 70%. Это значит, что поверхностные сосуды тромбогенны - вылечивая пациента, вы сразу же привносите ему новую болезнь. Дальше он должен жить на гепарине или других препаратах, либо ждать, когда образуется тромб и эмболия. А здесь уже с нетерпением ждут юристы США, которые готовы отыграть по старому сценарию. И проблема эндотелизации пока не решена. Возможный вариант - выделение клеток-предшественников костного мозга с помощью мобилизации специальными препаратами и хомингом на органе, но это пока очень далёкая от практики фантазия.
- Второй метод крайне оригинален и очень радует своей циничностью. Берём клетку (фибробласт) пациента, добавляем 4 гена. Кладём полученную клетку в бластоцисту (зародыша животного) и начинаем выращивать зверушку. Получается, например, свинья с человеческой поджелудочной железой - так называемая химера. Орган полностью "родной", только вся инфраструктура вокруг - кровеносные сосуды, ткани и так далее - от свиньи. А они будут отторгаться. Но ничего. Мы берём свинью, вырезаем нужный орган (свинья при этом полностью расходуется), а затем убираем с помощью специальной обработки все свиные ткани - получается как бы органический каркас органа, который можно использовать для выращивания нового. Некоторые исследователи пошли дальше и предложили следующий лафхак: давайте заменим свинью на суррогатную мать. Тут как: кроме 4 генов в клетку добавляется ещё один, отвечающий за ацефалию (отсутствие головы). Нанимается суррогатная мать, которая вынашивает нашего общего друга-эмбриона. Он развивается без головы, у ацефалов это хорошо получается. Затем - УЗИ, выяснение, что ребёнок получается неполноценный, и юридически-разрешённый аборт. Нет головы - нет человека, значит, никого мы не убивали. И тут - раз! - у нас тут появился теоретически легальный биоматериал с неразвитым органами пациента. Быстро имплантируем их! Из очевидных минусов - ну, кроме моральной стороны - организационная сложность и возможные юридические осложнения в будущем.
- И, наконец, есть третий метод, про который и идёт речь. Он же самый современный - трёхмерная печать органов. И именно им занимаются в новой лаборатории. Смысл такой: не нужны неорганические каркасы (клетки сами себя прекрасно держат), не нужно у кого-то брать органы. Пациент отдаёт немного своей жировой ткани (есть у каждого, в ходе экспериментов жаловались только тощие японцы), из неё методом последовательной обработки клеток получаются необходимые конструкционные элементы. Создаётся трёхмерная модель органа, конвертируется в CAD-файл, затем этот отдаётся 3D-принтеру, который умеет печатать нашими клетками и понимает в какую точку трехмерного пространства ему нужно "уложить" конкретный тип клетки. На выходе - тканевый конструкт, который надо поместить в специальную среду, пока не начались проблемы с гипоксией. В биорекаторе тканевый конструкт "созревает". Потом орган можно "трансплантировать" пациенту.
Очевидные сложные места метода следующие:
- Получение модели органа. Нужно где-то взять схему. Это довольно просто.
- Получение самих клеток. Очевидно, нам нужен материал для печати органа.
- Сборка принтера, чтобы клетками можно было печатать (куча проблем с образованием структуры органа).
- Гипоксия (отсутствие кислорода) во время создания органа.
- Реализации питания органа и его созревание до готовности.
Итак, 3D-принтер - это только кусок линии по фабрикации органов: его нужно обеспечить чертежом, материалом, а затем полученную модель органа из клеток ещё вырастить. Теперь давайте посмотрим по шагам, как все описанные выше задачи решаются.
Модель органа
Итак, берётся CAD-файл (сейчас - формат stl) с моделью органа. Проще всего получить модель, сделав трёхмерное сканирование самого пациента, а затем доработав данные руками. Сейчас текущие конструкты моделируются в AutoCAD.
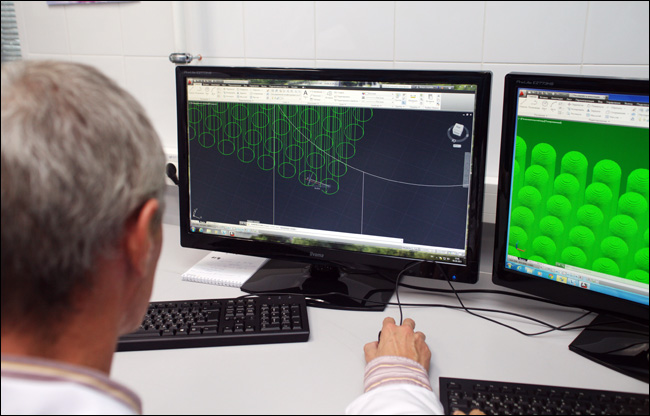
Видно моделирование. 3D-структура как у обычной детали - только вместо пластика будут тканевые сфероиды.
Материал
Берётся материал - тканевые сфероиды, которыми будет идти запечатка. В качестве основы используется гидрогель, выполняющий функции соединительной структуры. Затем 3D-принтер печатает орган из этих вот тканевых сфероидов.
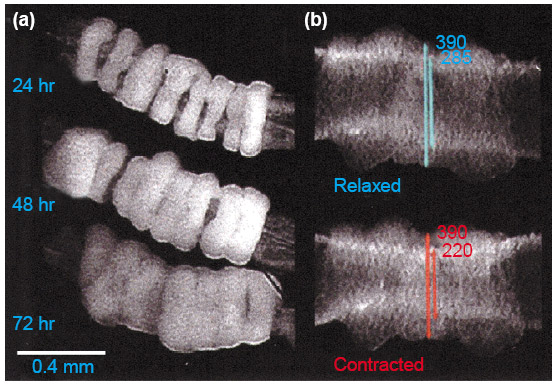
Первый опыт, подтверждающий, что из кусочков можно собрать целый орган: учёные разрезали на фрагменты сердце цыплёнка и срастили заново. Успешно.
Теперь вопрос - где взять клетки для этого материала. Лучшие - человеческие эмбиональные стволовые, из них можно сделать клетки для любой ткани последовательной дифференцировкой. Но их трогать, как мы знаем, нельзя. Зато можно брать iPS - индуцированные плюрипотентные стволовые клетки. Их можно сделать из костного мозга, пульпы зуба или обычной жировой ткани пациента - и их производят различные компании по всему миру.
Схема такая: человек обращается в клинику, делает липосакцию, жировая ткань замораживается и кладётся в репозиторий. При необходимости - достаётся, из неё делаются нужные клетки (ATDSC, один такой комплекс есть в России) и затем дифференцируются по назначению. Например, из фибробластов можно сделать iPS, из них - почечный эпителий, а дальше - функциональный эпителий.
Машины для автоматического получения таких клеток производятся General Electric, например.

Центрифуга. Первый этап отделения материала из жировой ткани.
Из этих клеток формируются шарики в специальных микроуглублениях на твёрдом материале. В углубление на молде помещается клеточная суспензия, затем клетки сращиваются, и образуется шарик. Точнее - не очень ровный сфероид.
Обработка конструкционных блоков
Следующая проблема - клетки в картдидже горят желанием срастись. Тканевые сфероиды должны быть изолированы друг от друга, иначе они начнут срастаться раньше срока. Их нужно инкапсулировать, и для этого используется гиалуроновая кислота, получаемая из сыворотки крови. Её надо совсем мало - просто один тончайший слой. Она также быстро "уходит" после печати.
Печать
Головка 3D-принтера имеет три экструдера: две форсунки с гелем и устройство, выдающее тканевые сфероиды. В первой форсунке с гелем - тромбин, во второй - фибриноген. Оба геля относительно стабильны, пока не соприкасаются. Но когда белок фибриноген расщепляется тромбином, образуется фибрин-мономер. Именно им как бетоном скрепляются тканевые сфероиды. При глубине слоя, соответствующей диаметру сфероида, можно последовательно наносить материал ряд за рядом - сделали слой, закрепили, перешли к следующему. Затем фибрин легко деградирует в среде и вымывается при перфузии, и остаётся только нужная ткань.
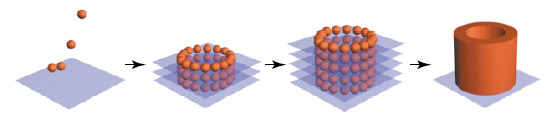
Вот так будут печататься трубочки
Принтер печатает слоями по 250 микрометров: это баланс между оптимальным размером блока и риском гипоксии в сфероиде. За полчаса можно напечатать тканево-инженерную конструкцию 10х10 сантиметров - но это ещё не орган, а тканево-инженерная конструкция, "сопля" на жаргоне. Чтобы конструкция стала органом, она должна жить, иметь чёткую форму, нести функции.

Микроскоп с огромным фокусным расстоянием смотрит на стеклянный куб с 3D-принтером.

Печатающая головка. Пока идут тесты комплекса на пластике. Принтер сейчас печатает расходный материал, пластиковые приспособления-молды для создания сфероидов. Параллельно идут тесты стерильного бокса для 3D-принтера при работающем электронном устройстве.
Постобработка
Главный вопрос - это то, что клеткам, вообще-то, не плохо бы иметь доступ к кислороду и питательным веществам. Иначе они начинают, грубо говоря, гнить. Когда орган тонкий, проблем нет, но уже с пары миллиметров это важно. Правда, у слона, например, есть хрящи до 5 миллиметров - но они вмонтированы там, где создаётся большое давление из-за массы остального слона. Так вот, чтобы напечатанный орган не испортился в процессе фабрикации, нужна микроциркуляция. Это делается печатью настоящих сосудов и капилляров, плюс с помощью тончайших перфузионных отверстий, проделываемых неорганическими инструментами (грубо говоря, конструкционные блоки поступают на полимерном "шампуре", который потом вынимается).

Уплотнение ткани
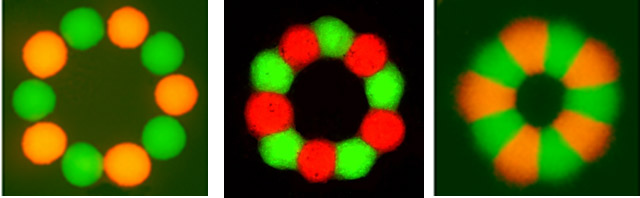
Тканевое объединение нескольких типов клеток без смешения
Будущий орган помещается в биореактор. Это, сильно упрощая, банка с контролируемой средой, в которой на входы и выходы органа подаются нужные вещества, плюс обеспечивается ускоренное созревание за счёт воздействия факторами роста.
Вот что интересно - архитектура органа обычно похожа на привычный по ООП инкапсулированный объект - артерия входа, вена выхода - и куча функций внутри. Предполагается, что биореактор позволит обеспечивать нужный вход и выход. Но это пока теория, собрать ещё не удалось ни одного. Но проект отработан до стадии "можно собирать прототип".
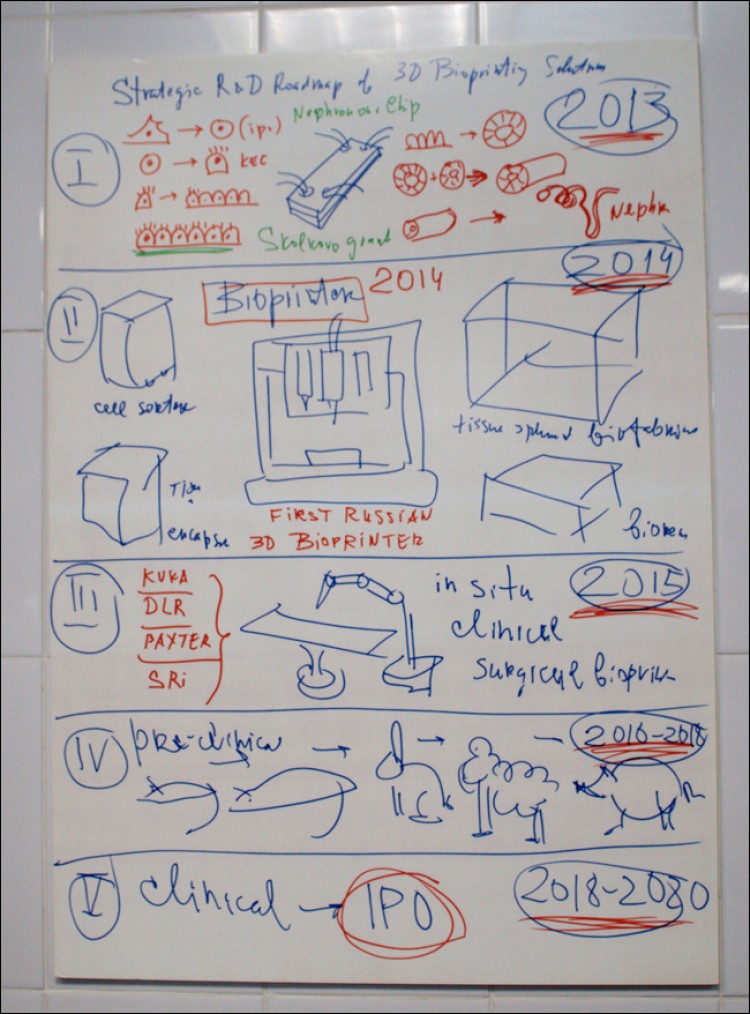
Висело в лаборатории. Видно первый этап: получение базовых элементов, второй - 3D-принтер с тремя экструдерами, третий - уход от прототипа к промышленной модели, затем испытания на животных, затем выход на IPO и установка людям.

Линия целиком - клеточный сортер, фабрикатор тканевых сфероидов, принтер, перфузионная установка
Рынки
Теперь кому всё это нужно на стадии, пока нет самих органов.
Первые же крупные клиенты - военные. Собственно, как не трудно догадаться, DARPA ходит в гости ко всем учёным, занимающимся такой темой. У них два применения - испытательное (много что нельзя испытывать на живых людях, а хочется - отдельный орган был бы очень кстати) и лечебное. Например, бойцу демократии отрывает руку, а до госпиталя ползти сутки. Хорошо бы закрыть дыру, снять боль, дать ему возможность стрелять ещё 5 часов, а затем на своих двоих прийти к медсестре. В теории возможны либо роботы, которые соберут всё это по месту, либо заплатки из человеческих тканей, которые уже сейчас всерьёз думают ставить на ожоги.
Второй клиент - фарма. Там лекарства испытываются по 15 лет до выхода на рынок. Как шутят американцы, проще убить коллегу, чем мышку. На мышку надо собрать кучу документов в руку толщиной. Сертифицированные мышки получаются в результате очень дорогие. Да и результаты по зверьку отличаются от человеческих. Существующие модели испытаний на плоских клеточных моделях и на животных не достаточно ревалентны. В лаборатории мне сказали, что примерно 7% новых лекарственных формул в мире не доходят до клинических испытаний из-за нефротоксичности, выявленной на стадии преклинических испытаний. Из тех, что дошли, около трети имеют проблемы с токсичностью. Именно поэтому, кстати, одна из первых задач - проверка функциональности нефронов, сделанных в лаборатории. Ткани и органы с принтера будут существенно ускорять разработку лекарств, а это огромные деньги.
Третий клиент - госпитали. Рынок трансплантации почек с США, например - 25 миллиардов долларов. Сначала предполагается просто продавать 3D-принтеры в больницы, чтобы пациент мог получить что нужно. Следующий (теоретический) шаг - создание комплексов для печати органов прямо внутри пациента. Дело в том, что миниатюрную печатающую головку внутрь больного доставить часто намного проще, чем крупный орган. Но это ещё пока мечты, хотя нужные роботы существуют.
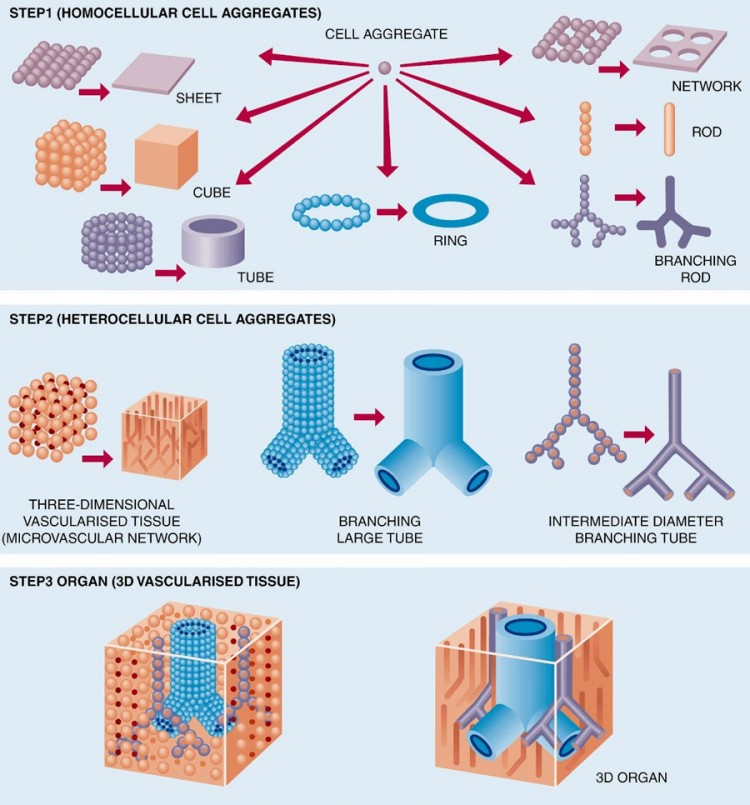
Вот примерно так оно должно работать
Да, здесь есть ещё одна важная тема: параллельно ведутся исследования по управлению тканевыми сфероидами за счёт магнитной левитации. Первые опыты были простые - в ткань засовывались железные "наноопилки", и сфероиды действительно летали как надо в магнином поле и доставлялись по месту. Но страдала дифференцировка. С опилками сложно выполнять нужные функции. Следующий логичный шаг - металл в инкапсулирующем слое. Но ещё круче - микроскафолды с магнитными частицами. Эти скафолды охватывают сфероид и ещё могут выступать в роли каркаса-соединителя, встающего сразу по месту, что даёт огромный простор для оперативной печати органов.
Ссылки
- Компания на Сколково
- Про российскую конферению по регенеративной медицине, которую делала эта команда

Куча бумаги, которую Миронов изрисовал за время рассказа. Почерк как у врача :)
Важные факты
- Ни один орган, напечатанный на 3D-принтере, ещё не был имплантирован человеку. Зато есть около десятка разных случаев успешной "установки" таких органов в животных.
- Миронов собрал уже три действующих 3D-биопринтера: 2 в Канаде, одни у себя в Бразилии. Новый в России должен стать лучше всех существующих.
- При сращивании сфероидов происходит компактизация ткани - например, почку придётся печатать раза в три больше, чем она будет внутри пациента - уже на последней стадии фабрикации она станет нормального размера.
- Сейчас научились делать базовые вещи, например, трубочки из разных типов ткани. После проверки функциональности клеток можно делать сложные конструкции. Например, из трубочек легко получается нефрон, а из множества нефронов - почка.
- Роботы нужны. В бронхах, например, 10 порядков ветвления - собирать это руками несколько утомительно, да и пациент не готов ждать тысячи лет. Будущее технологии быстрой печати - микрофлюидные экструдеры, которые делают до 10 тысяч капель в секунду. Вместе с быстрым роботом они могут дать отличный эффект.
- Напечатанные органы сразу атромбогенные - например, сосуды сразу же выстланы изнутри эндотелием. Это очень крутое преимущество: пациент не рискует, и ему не придётся всю жизнь сидеть на таблетках.
- Чекпоинты на близлежащую перспективу: патенты в РФ, полностью собранный принтер, статья в Science или Nature. Уже собрана международная команда ученых, в составе которой: доктор биологических наук, кандидат биологических наук, кандидат медицинских наук, доктор Ph.D.
- Первая почка будет в 2030-м году. Стоить она сначала будет как космос, но с масштабированием технологии - в разы дешевле, чем чужие органы на пересадку сейчас.